
《药物评价研究》2022年8月第45卷第8期发表了益诺思生物技术南通有限公司陈晓俊等的文章,简要介绍了组织病理学检查的基本要素、组织病理学的特点、组织病理学诊断注意事项、病理学数据分析和报告病理学结果的要点,以期为中国药物非临床安全性评价毒性病理学组织病理学检查及病理学数据分析提供一定参考。
毒性病理学是一门综合病理学和毒理学两门学科的交叉学科,主要研究有毒物质的潜在作用。毒性病理学评估通常需要对多个实验动物种属的 毒理学试验结果进行形态学评估,作为人类风险或安全评估的一个重要组成部分 。准确诊断病变和报告组织病理学检查结果将继续在药物非临床安全性评价中发挥关键作用。组织病理学是在光学显微镜水平上观察组织的形态学变化 。组织病理学结果常常构成毒理学研究中未观察到有害作用剂量(no observed adverse effect level,NOAEL)的基础,也是药物、化学物质、生物制品和医疗器械危害识别和风险评估的关键组成部分。美国毒性病理学会(Society of Toxicological Pathology,STP)已 经发布了毒性病理学的最佳实践指南,其目的是识别和确定组织病理学检查的基本要素和适当的技术,以减小观察者的偏差。本文简要介绍了药物非临床安全性评价组织病理学检查的基本要素、组织病理学的特点、组织病理学诊断注意事项、病理学数据分析和报告病理学结果的要点,以期为中国药物非临床安全性评价毒性病理学组织病理学检查及病理学数据分析提供一定的参考。
1.组织病理学检查的基本要素
STP于2004年发布的《毒性病理学的最佳实践指南》详细介绍了组织病理学检查的基本要素 。首先,在进行组织病理学检查前,病理学家应该获悉以下基本信息或数据:受试物的性质和其所属化合物类别、之前受试物在相同或不同动物种属中的研究结果(包括靶器官的效应)、试验方案、存活期数据(包括临床观察、体质量和摄食量等)、临床病理学数据(包括血液学、血清生化和尿液分析结果)、激素和酶诱导数据、动物的大体病理学观察以及脏器质量数据等。其次,在组织病理学检查中,病理学家要完成以下基本工作:评估组织取材、固定、修块、处理、切片和染色的质量,必要时要求重新制片;使用简明、标准化的诊断术语和诊断标准进行结果汇总和制作镜检结果表;必要时使用叙述文字来更好地描述复杂病变;以动物为单位评估组织(可对动物状况进行更全面的评估)或以器官为单位评估组织(可对变化进行更集中的检查,并在严重程度分级方面具有更好的一致性);使用1个可定义的、可重复的、有意义的严重程度分级系统;致癌试验还需区分增生、非典型性增生和肿瘤,区分良、恶性肿瘤,原发性或转移性肿瘤,以及进行死亡或濒死动物的死亡原因分析。最后,在组织病理学检查完成后,病理学家可使用以下程序来提高检查的准确性和一致性,如使用“盲检”技术对特定组织中特定变化进行重新评价;由同行评议病理学家对专题病理学家的诊断和结论进行同行评议;如不能达成一致,则由病理学工作组(Pathology WorkingGroup,PWG)进一步解决分歧。
2.组织病理学的特点
药物非临床安全性评价毒性病理学家的职责是进行组织病理学检查,不仅将检查结果清楚地呈现给其他病理学家,而且还要呈现给毒理学家和监管部门的审评人员。与经典诊断病理学中对每个形态异常进行冗长而详细的描述方法不同,毒性病理学家必须用有意义的数据汇总表的方式记录组织病理学检查结果,必要时可在病理学报告中详细说明与给药相关的病变及其生物学意义。因此,组织病理学具有解释性和描述性特点。
毒性病理学组织病理学评估最具挑战性的一个方面是在同一研究和不同研究之间,以及在不同病理学家之间,随着时间的推移保持一致。Bucci等指出除了不精确之外,毒理学数据的另一个特征是不一致。组织病理学诊断通常包含一定程度的主观性,因此,不同病理学家对同一病变使用的诊断术语应该相似,但并不一定完全相同 。尽管如此,没有任何两个病理学家能够在同一研究中对所有组织的检查得出相同的结果(包括诊断术语和病变分级),但是,合格的毒性病理学家应能够识别相同的给药相关病变。
药物非临床安全性评价的毒理学试验,大多数情况下由一位毒性病理学家单独对所有组织进行组织病理学检查。然而,在某些情况下,如大型试验或短时间内需完成的关键性试验,可能需要两位或更多位毒性病理学家共同进行组织病理学检查,分别检查部分组织,或者雄性和雌性动物的组织分别由不同的毒性病理学家进行检查。由同行评价病理学家对由多位病理学家进行组织病理学检查的试验中进行病理学同行评议,对于结果和结论达成一致性非常重要。根据不同的试验类型和毒性病理学家的个人偏好,组织病理学检查的阅片顺序可能会有所不同。对于一些小规模的试验,建议首先检查所有对照组动物,以建立试验用动物正常组织形态学范围。然后根据方案的要求对高剂量组动物进行检查,以发现给药相关病变和可能的靶器官。最后再对低、中剂量动物的靶器官进行检查。也可以采用对每组部分动物交替进行组织病理学检查。无论采用哪种阅片顺序进行组织病理学检查,毒性病理学家应明确毒理学试验的给药相关病变,并探讨其作用方式(mode of action,MOA)和判断其是否为有害作用。
3.组织病理学诊断注意事项
组织病理学诊断需要注意盲检、诊断术语、病变程度的分级、诊断阈值、诊断漂移5个方面。
3.1 盲检
毒性病理学家是否采用“盲检”的方式进行最初的组织病理学检查,在毒性病理学家和非病理学家之间尚存争议。大多数毒性病理学家不支持在最初的组织病理学检查时进行“盲检”。STP在“盲检”的立场文件中声明如下:STP明确支持对毒理学研究的实验动物组织采取非“盲检”的方式进行显微镜检查,STP支持长期以来的诊断病理学实践,即病理学家在对组织进行显微镜评估时,必须获得有关组织来源动物的所有可用信息。多年来,这种方法已经被证明是在必须考虑时间、成本和效率的情况下生成准确数据的有效方法。同样,美国兽医病理学家学院(AmericanCollegeofVeterintaryPathologists,ACVP)认为“盲检”不适用于毒理学研究的常规组织病理学评估。
毒性病理学家使用同期对照组动物来为某一试验所用特定种属、品系、性别和年龄的实验动物建立基线数据。如果没有基线数据,给药组和对照组之间的细微差别可能难以识别。另外,在初次阅片中对给药组动物信息的了解,使毒性病理学家能够评估相关形态学改变的范围,并确定最合适的诊断术语,包括在有需要时使用组合术语,来更准确地描述观察到的给药相关变化。同时,“盲检”时编码和解码数据所需的额外程序,以及病理学家记录所有观察结果(包括那些正常的)所需的额外努力,将增加试验成本和时间。因此,“盲检”对于最初的组织病理学检查来说既不科学,也不经济。
虽然不建议对初次阅片进行“盲检”,但毒性病理学家通常会对选定的靶器官进行“盲检”复查,以确认细微的变化,或明确给药对常见背景病变发生率或严重程度的相关影响。因此,组织病理学评估分为两个阶段,分别为识别阶段和确认阶段。在识别阶段,初步发现可能的给药相关变化;在确认阶段,给药相关性得到验证。如上所述,识别阶段传统上不采用“盲检”,以最大限度地减少与给药相关的细微变化的漏诊。确认阶段采用“盲检”方式,以防止报告假阳性或假阴性结果的可能性。当没有发现潜在的与给药相关的病变,或研究中与给药相关的证据非常明显时,无需进行确认。然而,当病变的因果关系不确定,或用于严重程度分级的标准差别很小,或剂量-反应关系不确定时,确认步骤是必要的。
3.2 诊断术语
显微镜检查的目的是通过比较给药组动物与对照组动物的组织病理学差异来确定受试物的主要病变。重要的是,显微镜观察结果应以一致、客观的方式记录,便于制表和比较组间效应。因此,应选择能清楚表达组织重要变化的标准化术语。国际公认的毒性病理学诊断术语标准是为了统一毒性病理学的术语和诊断标准而制定的,包括STP的术语和诊断标准标准化系统(standardizedsystemofnomenclatureanddiagnosticcriteria,SSNDC),以及病变术语及诊断标准国际协调(internationalharmonizationofnomenclatureanddiagnosticcriteriaforlesions,INHAND)项目。INHAND项目目前已经发表了大鼠、小鼠15个系统或脏器的增生性病变和非增生性病变的标准化术语和诊断标准,并且陆续增补了小型猪、犬、非人灵长类和兔的标准化术语和诊断标准,组织病理学评估中所用术语和诊断标准有了可供参考的国际通用的最佳实践指南性文件。此外,许多毒性病理学著作也提供了诊断和诊断标准的指导。
形态学诊断术语的建立通常包括器官或组织的部位,主要的病理学变化和修饰语。修饰语可以限定器官内的亚部位、分布、持续时间、特征和严重程度等。病理学家的职责是对形态、部位和发病机制相似的病变使用相同的术语进行统一诊断,以便能最好地描述与给药相关的变化。
肿瘤被定义为一种异常生长的组织块,且与正常组织生长不协调,在引起这种变化的刺激停止后,仍以同样的方式过度生长。在毒性病理学中,对于肿瘤性病变,诊断应表明肿瘤是良性还是恶性的、原发性还是转移性的。也需注意肿瘤的多发性及其成对脏器中双侧或单侧发生。继发于肿瘤的病变(如炎症和坏死)通常无需记录,因为这些继发性变化很少提供有用的信息。增生性病变的诊断标准应相对客观,最好能合理地预测其生物学行为。然而,某些具有形态学连续性的增生性病变,鉴别诊断特征不明显(如增生与腺瘤)。病变的大小可能是鉴别增生与腺瘤的主要标准(尽管不是唯一标准)。重要的是要认识到,在某些情况下,大小可能不是生物学行为的可靠预测指标。
3.3 病变程度的分级
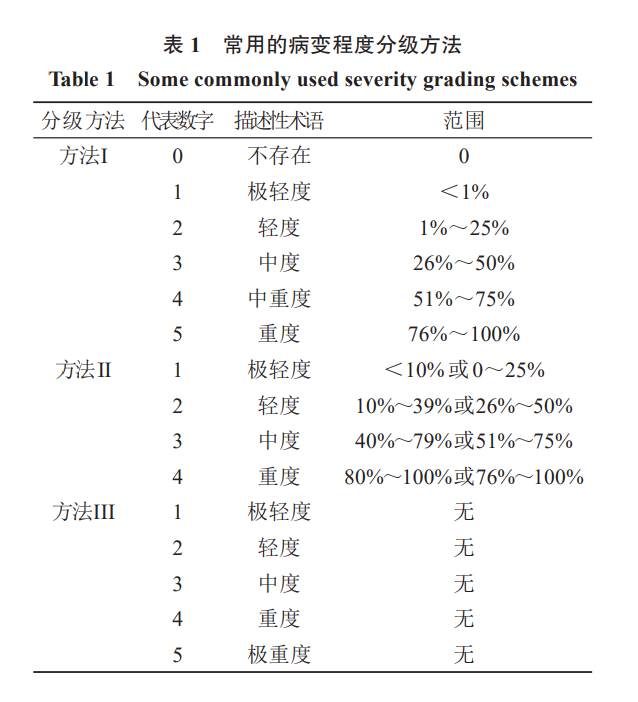
病变程度的分级是一种半定量方法,常规的组织病理学评估通常采用半定量方法。病变程度的分级被用作诊断修饰语,主要用于非肿瘤性病变,在识别发生率无明显增加的给药相关性变化时特别有用。病变程度分级主观性较强,因此必须明确定义,不仅可为审评人员提供某一病变的变化范围,而且还有助于同行评议的开展。对于一些严重程度分级没有意义的病变(如肿瘤、囊肿、自溶和先天性异常),病理学家可不进行分级,通常记录为存在(presence,P)即可。
病变程度分级没有标准化的指南,通常使用4级或5级分级方法,由描述性术语或代表数字来表示组织受累及或损伤范围,一些常用的病变程度分级方法见表1。
3.4 诊断阈值
除了记录与给药相关的改变和明显的自发性病变外,毒性病理学家还必须确定是否记录正常组织形态学的微小变化。阈值是确定正常形态学中哪些变化将被记录,哪些变化低于阈值而不会被记录的实践依据。这些变化可能是与年龄相关的微小变化,也可能是某一动物群体中正常的解剖学差异。然而,在确定常见自发性变化的阈值时必须小心,因为如果没有记录这些变化,受试物对这些变化的发生率或严重程度的可能影响更难确定。尽管如此,设置1个适当的阈值有助于简化试验中产生的诊断数据,从而使与给药相关的变化更加明确。
3.5 诊断漂移
诊断漂移指的是术语或严重程度分级的逐渐变化,这种变化可能发生某一试验的一个或多个试验组中,或者发生在对多个试验进行比较时。使用多个术语或许多不同的修饰词来诊断不同形态学改变但本质相同的变化是诊断漂移的原因之一。随着病理学家更充分地了解给药相关作用的总体情况,在组织病理学评估过程中,术语和病变程度分级也可能发生变化。包含大量动物和组织的大型试验,必须在相对较长的时间内进行评估时,诊断漂移更常见。诊断漂移是镜检差异的来源,如果足够严重,可能造成错误或掩盖给药相关的变化,或可能使未观察到作用剂量(noobservedeffectlevel,NOEL)的判断复杂化。1种可使诊断漂移最小化的组织病理学评估方法是对所有组别的几只动物一起进行评估,如对照组、高剂量组、低剂量组和中剂量组各5只动物。如果确认出现了诊断漂移,应重新评估受影响的组织。在这些情况下,对特定组织和病变进行“盲检”可能有帮助。此外,由另一位病理学家对动物和组织的特定亚群以及试验结论进行同行评议,若专题病理学家与同行评议病理学家存在分歧,还可通过PWG对感兴趣的靶器官进行审查,以提高组织病理学评估的准确性和一致性。
4.病理学数据分析
病理学结果的分析需要对大体剖检所见、器官质量、组织病理学数据、存活期数据和临床病理学结果进行综合评估。而且,病理学结果必须结合其他试验因素,如试验设计(给药剂量、持续时间、给药途径、暴露后恢复期)、实验动物(种属、品系、年龄、性别、安乐死方式)和动物饲养方式(群养或单笼饲养、自由摄食或优化饮食、笼具、垫料),进行综合分析和讨论。
4.1 受试物相关结果和有害作用的判定
在判定给药组和对照组之间的差异是由于偶然性还是与受试物相关的作用,以及与受试物相关的作用是否为有害作用时,应考虑若干因素。首先,判断与受试物无关的作用应考虑的因素包括:无明显剂量-反应关系;某一组别的变化是由于1只或多只动物的异常值所致;某一指标的测量本质上不精确;变化在正常变异范围内(历史对照数据或正常参考值);缺乏生物学的合理性。
其次,判断与受试物相关的作用是否为有害作用应时,应考虑的因素包括:识别受试物相关病变的病理性质及其靶细胞、组织、器官是判断有害作用的先决条件;病变的严重程度是判断其是否为有害作用的重要因素;在许多情况下,包括某一特定病变的相关病变组合为有害作用,但该病变并非有害作用;加重自发性或背景病变;有害作用的判断不应仅限于原发性反应或直接作用;形态学变化的可逆性不一定表示非有害作用,而缺乏可逆性的形态学变化意味着需要额外关注并增加了其为有害作用的可能性;有害作用的判断要基于目前试验所观察到的病理学结果而非推测的病理学结果;有害作用只能在动物模型的背景下进行判断,外推与人类的相关性应当在非临床试验的有害作用确定后再考虑等。
在判定结果或有害作用时,上述因素都不应孤立地加以考虑,而应结合具体试验的相关信息进行综合分析,如试验方案和先前试验中受试物的已知作用等,采用证据权重方法(weight-of-evidenceapproach)。例如,是否存在剂量-反应关系是最终确定对照组和给药组之间的病理结果差异是与受试物相关反应还是偶发性改变的一个重要因素。雌雄动物之间的一致性可能支持受试物相关作用,但药物的药动学或药效学反应的性别差异可能导致性别特异性靶器官反应或不同程度的反应。
历史对照数据可以作为评估与受试物相关效应或有害作用的有效工具,不仅可以提供实验动物背景病变(包括非增生性和增生性病变)或正常差异的发生率,还有助于识别同期对照组动物中的异常值或判断给药组动物与受试物相关病变。
根据对有害作用与适应性反应问题的文献综述,提出了有害作用和适应性反应的定义。(1)有害作用:动物模型中损害细胞或有机体维持稳态和(或)应对进一步有害刺激的反应能力的形态学、生理学、生长、发育、生殖或生命周期等方面的药物相关性改变,或对其他影响的敏感性增加。(2)适应性反应:在毒理学的背景下,细胞或有机体对外源化学物质作出反应,使细胞或有机体能在含有外源化学物质的新环境中生存而功能不受损害的过程。
评定受试物造成的有害作用,由于诸多因素而变得复杂。大多数有害作用的定义并没有确定的标准。确定有害作用通常需要毒性病理学家采取具体情况具体分析(case-by-case)的方法,不能一概而论。
4.2 原发性作用和继发性作用的判定级
暴露于受试物后观察到的器官或组织的一些变化可能是由于其他器官或组织的原发性作用引起的,也可能继发于全身毒性。这些继发性作用一般不被认为是有害作用。然而,在某些情况下,继发性反应也可能在受累器官产生有害作用。
毒理学研究中,与体质量下降相关的一些器官重量参数的变化通常是继发性作用。如果不考虑器官质量和相关体质量下降之间的关系可能会导致对器官质量结果改变的误解。一个常见的例子是没有考虑体质量下降对脏器质量/体质量的影响。一些器官的绝对器官质量,如脑和睾丸受体质量变化的影响较小。在这些情况下,由于分子(脏器质量)不变,但分母(体质量)减少,这些器官的脏器质量/体质量增加,其实是与给药相关的体质量下降有关。由于缺乏其他原发性作用的证据,脏器质量/体质量的增加不应被解释为受累及器官的原发性病理改变。与之相反,许多器官,最明显的是肝脏,脏器质量会随着体质量的下降而下降,所以在体质量下降的情况下,肝脏质量与体质量比可能相对于对照组保持正常。如果肝脏脏器质量与体质量比的增加,即使与体质量的减少有关,也可能表明肝脏的原发性质量增加。
Bailey等研究了体质量变化对脏器质量、脏器质量与体质量比和脏器质量/脑重比的影响。脏器质量与体质量比是评价肝脏和甲状腺脏器质量效应最合适的指标,脏器质量与脑重比是评价肾上腺和卵巢脏器质量效应最合适的参数最合适。对于其他器官,建议采用其他方法,如统计学方差分析。虽然这些结果分析主要用于大鼠,但这类体质量和脏器质量相关性通常也适用于其他种属动物。
许多组织病理学变化也可能继发于严重的全身毒性,这可能使对受试物相关效应的解释复杂化。例如,在常规毒理学试验中高剂量组动物淋巴器官,特别是胸腺的萎缩和脏器质量减少,可能是应激反应所致。免疫抑制药物通常对淋巴器官产生剂量相关性效应,不伴随其他显著改变。相反,继发于应激的淋巴器官改变通常仅限于高剂量组动物,并伴随其他毒性症状出现,如体质量减轻或典型的血液学检查结果改变。
另一种常见的继发性镜检结果是雌性生殖器官的萎缩,是由于非特异性的一般毒性所致,与应激或摄食量减少,进而导致促性腺激素分泌减少有关。有时很难区别是给药后应激或体质量影响而产生的非特异性继发性反应,还是受试物对雌性生殖器官的原发性作用。然而,区分对生殖器官的原发性和继发性作用对生殖系统危害的分类具有重要意义。
4.3 毒性病理学统计分析
在非致癌试验中,毒性病理学数据主要是对器官质量进行数据分析统计,分析器官的绝对质量、分析器官相对质量(器官质量与终末体质量的比值)、终体质量作为协变量的协方差分析(analysisofcovariance,ANCOVA)。器官质量分析推荐的方法是通过使用终末体质量作为协变量进行ANCOVA,因为给药和器官质量有关时这种方法更敏感。同时,ANCOVA还可避免给药影响终末体质量时器官质量的虚假改变。组织病理的境检结果主要以表格形式列出,不进行统计。
在致癌试验中,肿瘤发生率及死亡率数据的统计分析是致癌试验结果解释的关键内容,目前国际常用致癌数据的统计方法有Peto检验、Poly-3检验及Poly-k检验等,最常用的分析方法是Peto描述的方法,即Peto检验。Peto检验要求根据是否引起动物死亡,将肿瘤分为致命性或偶发性。如果肿瘤不能分为致死性或偶发性,可以使用Peto方法的替代方法,如Poly-3检验或Poly-k检验进行统计学评价。在1个致癌试验中不要采用2种统计分析方法,因为这将会增加假阳性结果的可能性,并在很大程度上使统计结果的解释复杂化。SAS软件的某些程序例如MULTTEST及LIFETEST可用于致癌试验病理数据的Peto及Poly-3统计分析。
正确使用统计学方法对于毒性病理学的试验结果有关键意义,同时可以帮助毒性病理学家分析和掌握准确的试验结果。
5.报告病理学结果
毒性病理学家解剖病理学和组织病理学检查的结果和结论必须准确和完整地反映在病理学报告中。毒性病理学家还要判断受试物相关的毒性反应以及这些结果的意义(如有害作用或适应性反应)。药物非临床安全性评价机构或合同研究组织(contractresearchorganization,CRO)通常会提供1份综合的最终试验报告或将单独的病理学报告附在最终试验报告后面。无论报告格式如何,毒性病理学家应和其他参与试验的科学家沟通,提供重要试验结果的综合分析,包括存活期临床表现、临床病理学数据、脏器质量数据、剖检结果和药动学数据等。病理学报告应包括与受试物相关的脏器质量改变结果、死亡动物的死亡原因分析以及与受试物相关大体和组织病理学结果及讨论,制作剖检个体表、剖检汇总表、镜检个体表和镜检汇总表等表格,必要时应讨论与受试物相关病变可能的作用方式(MOA)以及是否为有害作用等。同样重要的是,最终试验报告应保持病理学结果解释的完整性。
6.结语
毒性病理学是药物非临床安全性评价毒理学试验的重要组成部分,其中组织病理学评估结果对药物非临床毒理学试验的结论至关重要。近10年来,随着中国在创新药物研发领域的快速进展,以及国际上药物非临床安全性评价领域的互动合作越来越广泛,药物非临床安全性评价机构或CRO中申报美国食品药品监督管理局(FDA)和(或)经济合作与发展组织(OECD)的项目日益增多,这些对中国药物非临床安全性评价毒理学试验毒性病理学评价的方法和实践尽快与国际先进国家和组织接轨提出了新要求。
目前国内的毒性病理从业人员大多具有临床病理学或兽医病理学的专业背景,但实验动物病理的培训却略显不够,这与中国尚未实行资格认可制度有关。目前诊断术语和诊断标准尚未完全统一,严重影响了不同国家和地区实验室间病理诊断人员对病变的描述或记录、报告的解读以及同行间交流和诊断水平的提高。本文从组织病理学检查的基本要素和特点、病理诊断的注意事项、病理学数据分析和病理学结果的报告等方面进行了简要描述,希望有助于中国毒性病理学从业人员规范使用国际通用的诊断术语和诊断标准、开展组织病理学评价工作,并出具合格的病理学报告。使中国的毒性病理学从业人员在不断提高病理诊断水平的同时,进一步促进中国与其他国家的药物安全性评价数据互认工作,为中国创新药物进入国际主流市场奠定基础。4
延申阅读
