·

2003年,国家食品药品监督管理局发布施行《药物非临床研究质量管理规范》(原局令第2号),并制定了《药物非临床研究质量管理规范检查办法(试行)》。2007年,国家食品药品监督管理局对《药物非临床研究质量管理规范检查办法(试行)》进行了修订,并更名为《药物非临床研究质量管理规范认证管理办法》。2017年,国家食品药品监督管理总局制定了新的《药物非临床研究质量管理规范》(以下简称药物GLP)。
2022年3月24日,国家食品药品监督管理局发布《国家药监局关于药物非临床研究质量管理规范认证公告(第5号)(2022年第27号)》,截至本次公告,共有76家机构符合药物GLP要求,其中同时具备OECD GLP资质的实验室共有8家,接受过FDA GLP检查的机构共有12家(在机构列表中标记英文名称)。
与🔗上次发布(20211018)相比,本次新增3家机构,另有10家机构扩增试验领域,变化部分高亮标记。

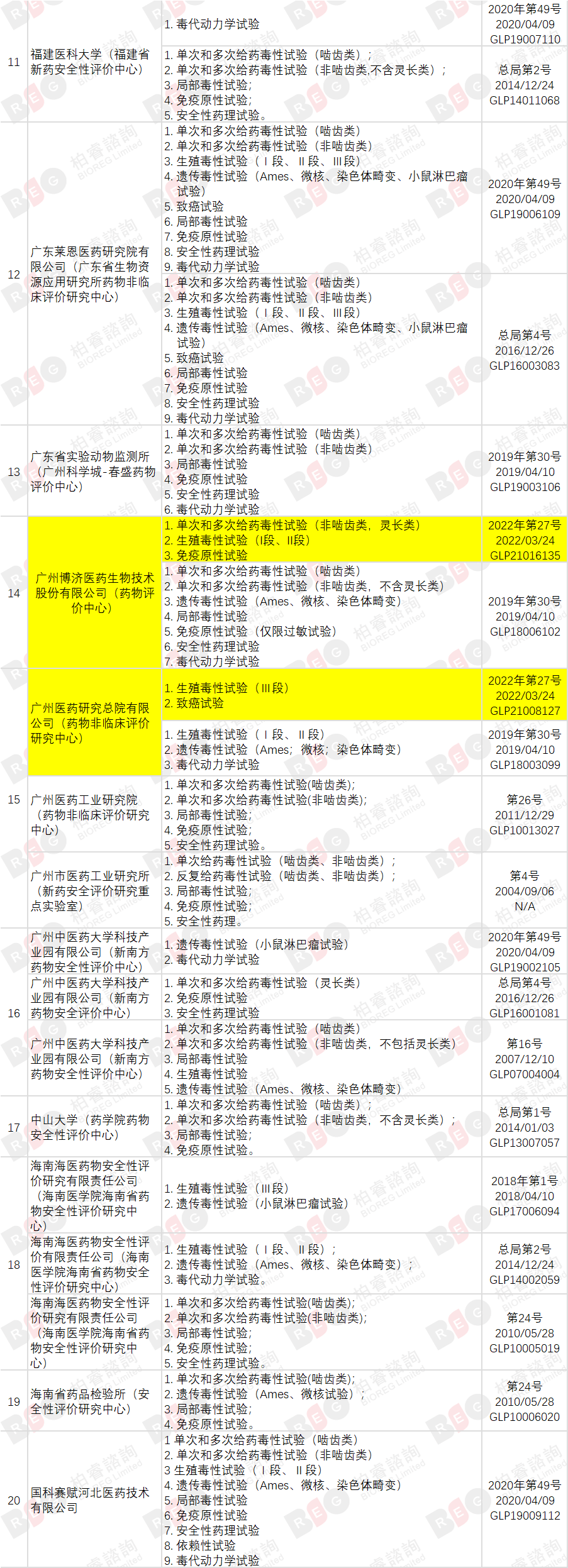

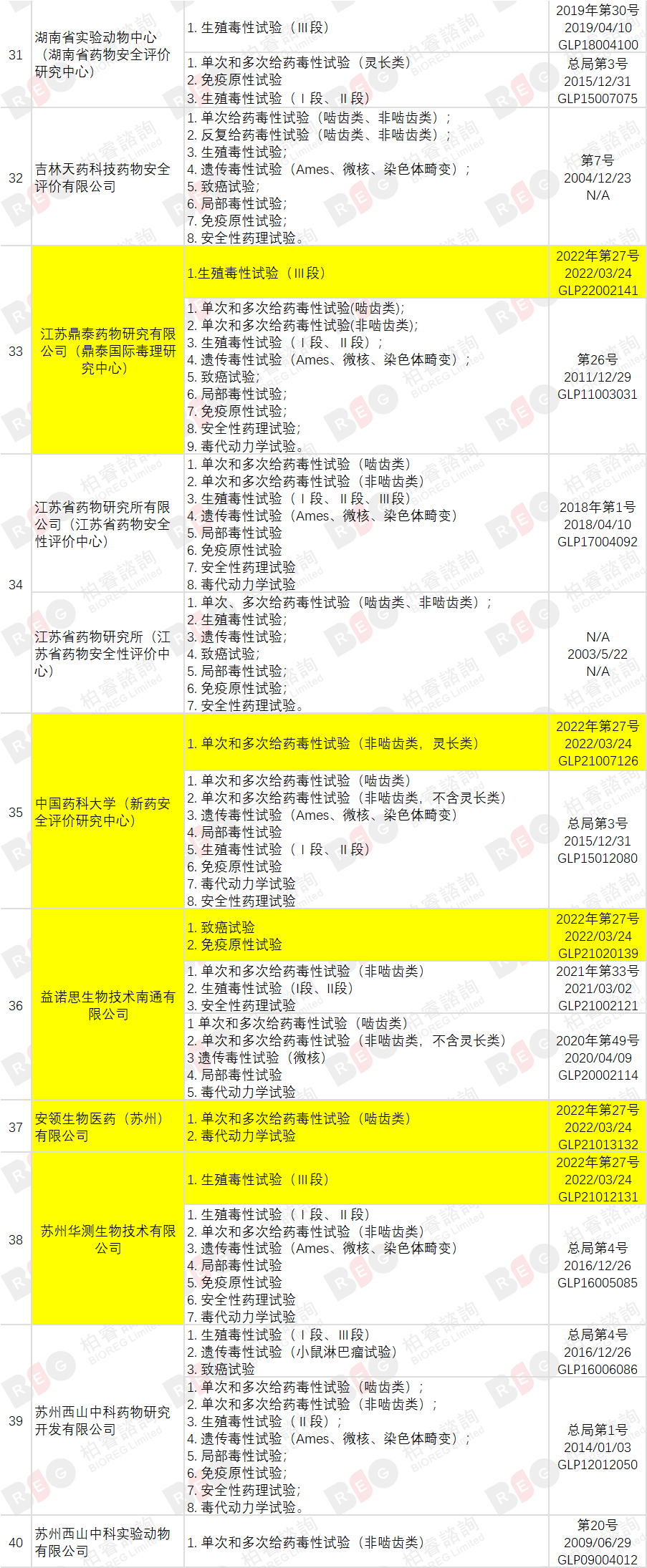

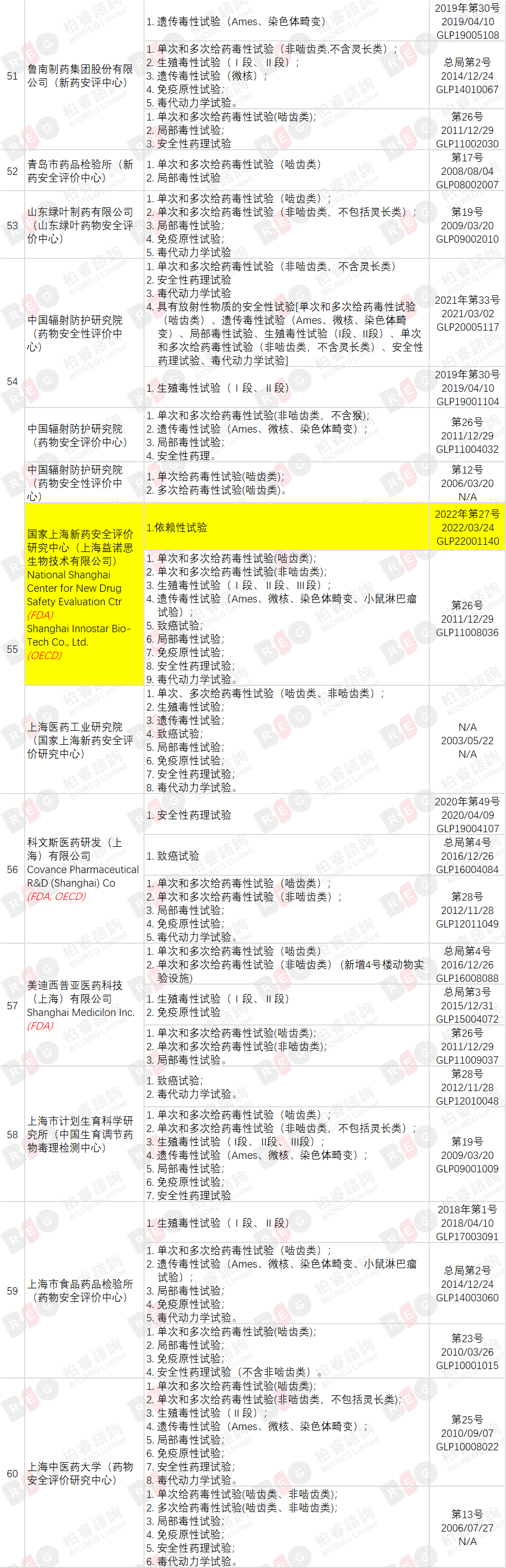

(点击查看大图)
延伸阅读
