·

FDA
根据《联邦食品、药品和化妆品法》(FFDCA)和《公共卫生服务法》(PHSA),FDA要求开展安全性评价研究的非临床实验室遵循GLP准则(21 CFR Part 58),目的是保证企业提交的临床前安全性研究资料的真实、准确和完整,从而达到确保临床受试者安全以及保障产品上市后使用者安全。
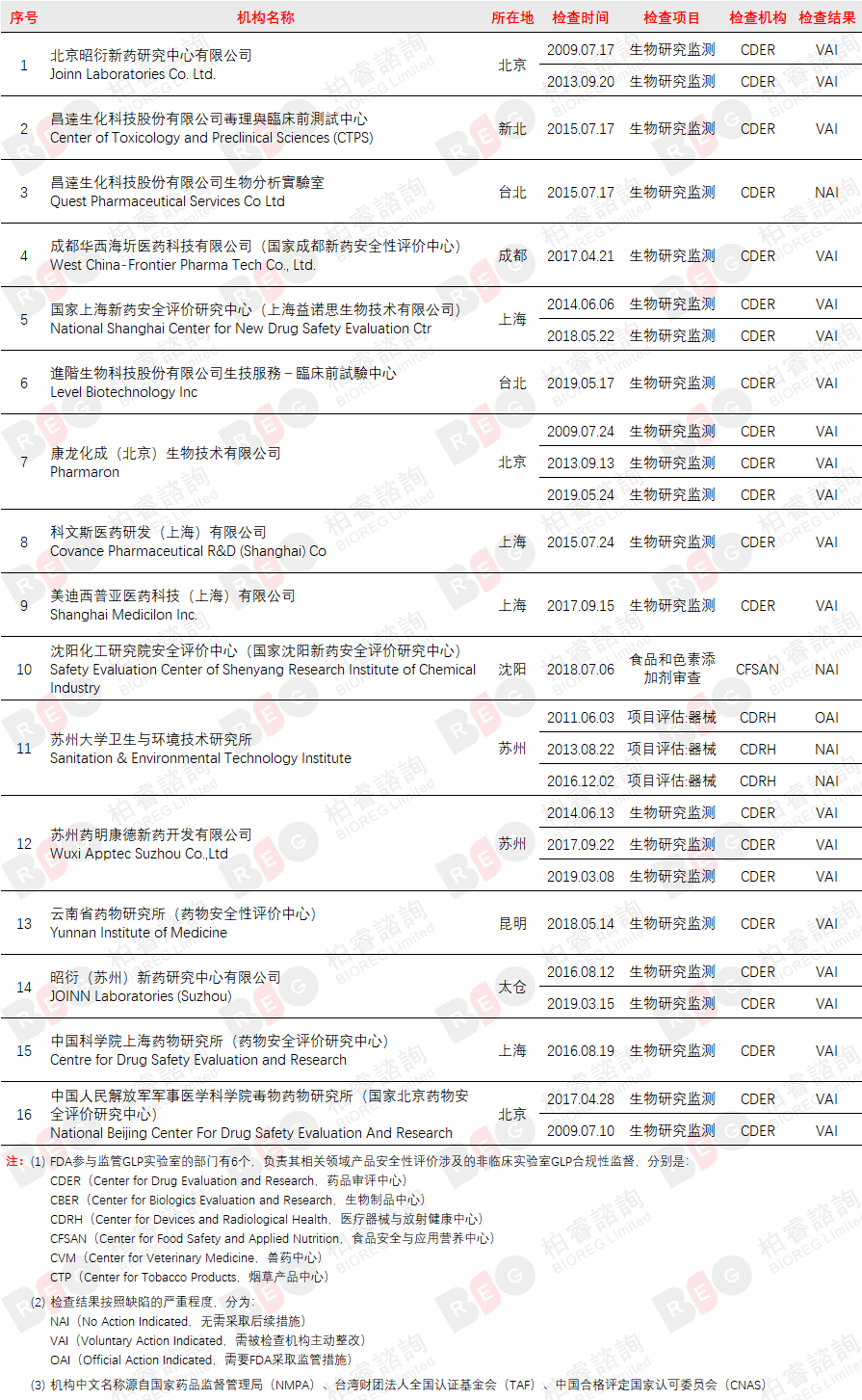
截至2021年6月30日,FDA共对16家中国试验机构开展28次GLP检查,记录如下:
EPA
根据《联邦杀虫剂、杀菌剂和杀鼠剂法案》(FIFRA)和《有毒物质控制法案》(TSCA),EPA于1983年颁布实施两个良好实验室规范标准(40 CFR Part 160、40 CFR Part 792),用于农药市场准入和研究,以及化学品人体健康和环境效应测试。由农药项目办公室(OPP, Office of Pesticide Programs)和污染预防和有毒物质办公室(OPPT, Office of Pollution Prevention and Toxics)分别负责农药和化学品领域的GLP数据审查,执行与合规保证办公室(OECA, Office of Enforcement and Compliance Assurance)负责GLP符合性的监管和检查。
截至2020年3月30日,EPA共对2家中国试验机构开展2次GLP检查,记录如下:

【数据来源】
- FDA, Nonclinical Laboratories Inspected under Good Laboratory Practices, 06/30/2021
- EPA, EPA Good Laboratory Practices Inspections, 03/30/2020
- TAF, GLP符合性登录名录
- CNAS, 获认可的机构名录
- 施爱民,秦珩.国际AAALAC认证的认识与实践[J].实验动物与比较医学,2006,26(4):265-267.
- 中华人民共和国农业农村部公告 第118号
【相关法规】
- 21 CFR Part 58: (FDA) Good Laboratory Practice for Nonclinical Laboratory Studies.
- 40 CFR Part 160: Good Laboratory Practice Standards (FIFRA)
- 40 CFR Part 792: Good Laboratory Practice Standards (TSCA)
GLP分享专栏

